Il sonno come linguaggio: quando una notte diventa un “biomarcatore” predittivo per 130 malattie
Da una sola notte di sonno, un modello di intelligenza artificiale riesce a predire il rischio futuro di 130 condizioni cliniche, anche anni prima della diagnosi.
Il 6 gennaio 2026 Nature Medicine ha pubblicato un lavoro che, senza tanti giri di parole, alza l’asticella: da una sola notte di sonno, un modello di intelligenza artificiale riesce a predire il rischio futuro di 130 condizioni cliniche, anche anni prima della diagnosi.
E no: non è l’ennesimo algoritmo per fare sleep staging.
Qui l’idea è più ambiziosa e – se vogliamo – più elegante: trattare il sonno come un linguaggio.
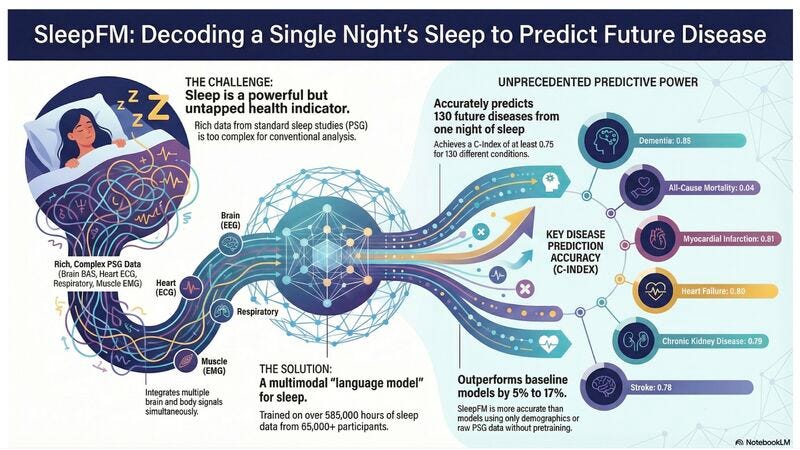
Un linguaggio multimodale fatto di cervello, cuore, muscoli e respiro: la classica PSG (polisonnografia) con EEG/EOG, ECG, EMG e segnali respiratori. E su questo linguaggio, costruire un foundation model – SleepFM – allenato su numeri che di solito vediamo nei modelli generalisti: 585.000+ ore di registrazioni da ~65.000 persone, con i partecipanti collegati alla loro storia clinica (EHR).
Se ti suona “troppo bello per essere vero”, è normale. Ma la direzione è chiarissima.
Perché questa notizia è grossa (davvero)
Dormiamo un terzo della vita. Eppure, nella medicina dei dati abbiamo spesso trattato il sonno in modo “povero”:
poche metriche (AHI, saturazioni, micro-risvegli…)
pochi task verticali (staging, apnee)
poca ambizione: “classifica”, “conta”, “segnala”.
Questo lavoro fa il contrario.
L’obiettivo non è riconoscere un’etichetta (stadio N2 / REM).
L’obiettivo è imparare una rappresentazione del sonno che catturi la fisiologia integrata e che, proprio per questo, diventi utile per predire traiettorie di malattia.
È un cambio di paradigma: dal sonno come evento notturno al sonno come biomarcatore digitale integrato.
Che cosa fa SleepFM, in pratica
Il paper mostra che SleepFM:
Costruisce una rappresentazione “olistica” del sonno e la usa per predire rischio futuro su larga scala.
Mostra performance solide: C-index ≥ 0,75 per 130 condizioni, includendo esempi ad altissimo impatto (mortalità, demenza, infarto, scompenso cardiaco, malattia renale cronica, ictus…).
Generalizza: regge su un dataset esterno (transfer su SHHS, escluso dal pretraining).
Questo ultimo punto è cruciale, perché nel mondo reale i dati del sonno sono sporchi, eterogenei, “di centri diversi”, con protocolli diversi. Se un modello non generalizza, resta un bel grafico nel paper.
Il punto tecnico che conta (detto semplice)
SleepFM non è “solo” un trasformatore messo sopra dei segnali.
L’architettura racconta una cosa importante: per far funzionare questi modelli devi rispettare la natura dei dati fisiologici (multicanale, asincroni, rumorosi, diversi per montaggio e strumentazione).
In sintesi:
CNN per imparare feature locali (pattern brevi nel segnale)
Transformer per aggregare informazione su tempi lunghi e tra canali
una strategia di training che rende il modello robusto anche quando manca una modalità: leave-one-modality-out contrastive learning.
Tradotto: il modello impara a “capire” il sonno anche se gli togli una parte del linguaggio (ad esempio meno canali o qualità diversa), senza collassare.
Questa è una delle differenze tra un prototipo accademico e qualcosa che può iniziare a respirare aria clinica.
Il vero valore: prevenzione e medicina longitudinale
Qui arriva la parte più interessante, perché sposta la discussione dal “wow tecnologico” al “che cosa ci faccio lunedì mattina”.
Se inizi a considerare il sonno come biomarcatore digitale integrato, succedono tre cose (e sono esattamente le tre che contano):
1) Risk stratification più precoce
Non aspetti che il paziente “manifesti” clinicamente.
Cerchi segnali fisiologici precoci e li usi per stratificare il rischio prima che i sintomi siano evidenti.
In sanità pubblica è oro: significa spostare energia e risorse a monte, non a valle.
2) Nuovi endpoint (non più solo “quante apnee”)
La medicina del sonno è stata troppo spesso ridotta a “quante apnee?” o “che stadio è?”.
Ma le malattie croniche e neurodegenerative non si muovono così: sono traiettorie, non scatti.
E qui l’idea di “pattern fisiologici complessi” associati a traiettorie di malattia diventa potente.
3) Una medicina davvero longitudinale
Il sonno è ripetibile, osservabile, potenzialmente misurabile nel tempo.
Se lo tratti come un segnale che accompagna la vita (e non come una fotografia occasionale), apri la strada a modelli che ragionano su trend e cambiamenti, non su istantanee.
Una provocazione utile: e se la prossima “analisi federata” partisse dal sonno?
Nella sanità digitale abbiamo un riflesso condizionato: “per fare prevenzione servono esami, referti, laboratorio”.
E se fosse vero… solo fino a ieri?
Immagina un futuro in cui la medicina preventiva non parte dal colesterolo o dalla creatinina, ma da un set di pattern fisiologici notturni. Non perché “il sonno sostituisce il laboratorio”, ma perché:
è un segnale integrato
cattura stress, infiammazione, disfunzioni autonome, alterazioni respiratorie e neurologiche
può essere longitudinale.
E adesso metti insieme questo con federated learning, governance e modelli foundation: improvvisamente il sonno diventa un candidato naturale per un’analisi distribuita su larga scala.
Le due domande serie (da farsi subito)
Per evitare l’effetto “hype → delusione”, ci sono due domande che separano la fantascienza dal roadmap.
1) Traslazione clinica: quanto può “scendere” dalla PSG?
Oggi è PSG (gold standard), quindi contesto clinico e centri del sonno.
Domani—con cautela—si vedrà quanto può scendere su sensori più leggeri senza perdere significato clinico.
Qui non serve tifare. Serve metodo:
quali modalità sono davvero indispensabili?
quali surrogate reggono?
quali popolazioni funzionano bene e quali no?
2) Bias & governance: generalizzazione non è un grafico
EHR, popolazioni diverse, differenze socio-demografiche, differenze di accesso alle cure.
Se un modello predice “rischio di demenza”, voglio capire:
che cosa sta catturando davvero
quanto è trasferibile tra contesti
come lo audito e come lo supervisiono
come evito che amplifichi disuguaglianze.
La frase chiave qui è una sola: validazioni prospettiche.
“Funziona nel paper” non basta.
Cosa cambia per chi fa sanità digitale (e per chi decide)
Se lavori su:
piattaforme di prevenzione
stratificazione di rischio
population health
percorsi cronici
integrazione tra dati clinici e segnali digitali
…questo paper ti mette davanti a una possibilità concreta: aggiungere una nuova classe di biomarcatori (multimodali, longitudinali, predittivi).
E se sei un decisore (pubblico o privato), il messaggio è:
Il sonno potrebbe diventare un “asset” clinico, non un dettaglio di stile di vita.
Quando una variabile passa da “soft” a “hard”, cambiano budget, priorità, standard e—inevitabilmente—policy.
Cosa mi porto a casa (in una frase)
L’AI non sta solo automatizzando compiti. Sta imparando nuove rappresentazioni della fisiologia.
E quando impari la rappresentazione giusta, improvvisamente puoi fare previsioni che prima erano fuori portata.
Link utili
Se domani avessimo un “Sleep Risk Score” affidabile e auditabile, come cambierebbero:
la medicina generale (invii, follow-up, counselling mirato)?
i programmi di prevenzione (targeting delle risorse)?
i percorsi per cardiometabolico e neurodegenerativo?
la ricerca clinica (endpoints e arruolamento)?